Diferenciamos uma mistura de uma substância pura normalmente através de suas constantes físicas, tais como: ponto de ebulição (PE), ponto de fusão (PF), densidade (d) e solubilidade (solub).As substâncias puras mantêm suas constantes durante as mudanças de estado, diferentemente das misturas. Exemplo:
- Água pura: - PE = 100ºC; PF = 0ºC; d = 1g/cm 3.
- Água e sal de cozinha (NaCl): não apresentam constantes.
- Álcool Puro: PE = 78,5ºC; PF = -177ºC; d = 0,79g/cm 3.
- Álcool e Água: não apresentam constantes.
Misturas
Mistura é a reunião de duas ou mais substâncias sem que haja reação química entre elas, e mantendo cada qual suas propriedades.
Na mistura de água e açúcar, não é possível distinguir visualmente um componente do outro: o açúcar desapareceu na água. Dizemos que essa é uma mistura homogênea.
Já na mistura de água e talco, é perfeitamente possível distinguir visualmente as duas substâncias.Dizemos, então, que essa é uma mistura heterogênea.
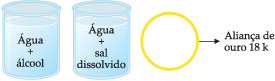 | A definição de misturas homogêneas e heterogêneas está ligada ao modo como se percebe a mistura. Assim, uma mistura que a olho nu nos parece homogênea, quando vista ao microscópio pode revelar-se heterogênea. Dizemos então que ela é homogênea do ponto de vista macroscópico e heterogênea do ponto de vista microscópico. |
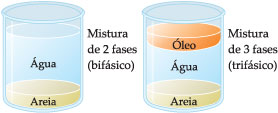 | As misturas heterogêneas cujos componentes só podem ser observados por microscópio, pois estão na forma de partículas muito pequenas podem ser chamadas de colóides. Entre outros são colóides: os alimentos como a gelatina e a maionese; alguns produtos farmacêuticos como pomadas e cremes; e o sangue. As misturas heterogêneas apresentam fases distintas. Por exemplo, uma mistura de água e pedaços de ferro é uma mistura heterogênea em que se percebem nitidamente duas fases, ou seja, dois componentes distintos: a água e o ferro. Dizemos então que essa é uma mistura bifásica. Do mesmo modo falamos em misturas trifásicas, tetrafásicas, etc. Cuidado para não confundir mistura com combinação de substâncias. Se você juntar, por exemplo, ácido clorídrico ao magnésio, o resultado será cloreto de magnésio e hidrogênio, que se desprende. | |
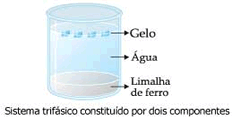 |
O resultado não é uma mistura homogênea, mas uma substância que antes não existia. É possível diferenciar uma mistura de uma substância pura observando suas propriedades específicas, como ponto de fusão e o ponto de ebulição.
A água pura, por exemplo, ferve a 100ºC (ao nível do mar). Essa temperatura (ponto de ebulição) permanece constante durante toda a fervura. Já quando se ferve uma mistura de água com sal, o ponto de ebulição aumenta. O mesmo vale para o ponto de fusão.
Referencia:
Disponível em http://www.sobiologia.com.br/conteudos/Oitava_quimica/materia11.php. Acesso em 03 de abril de 2012

Nenhum comentário:
Postar um comentário
Obrigada pelo seu comentário, espero te-lo ajudado!
Abraço, Roselaine Mezz